- 关键字: 代表性成果之三:复杂天然产物的生物合成和组合生物合成研究 发布者:宣传部 发布时间:2009-02-24 16:02:41 点击数: 8414次
|
代表性研究成果三
|
基础类或
应用基础类或基础性类
|
成果为第一完成单位
|
本室固定
人员参加
名单
|
是否
保密
|
|
复杂天然产物的生物合成和组合生物合成研究
|
应用基础类
|
是
|
刘文
唐功利
|
否
|
包括抗生素在内、具有生物活性的天然产物,在过去几十年里一直是人类治疗疾病的主要药物。与合成化合物相比,天然产物在化学结构方面体现了更为复杂和丰富的多样性。由于产生于自然,其化学结构和功能(多样的生物活性)之间的关系在长期的进化过程中得以选择和优化,往往赋予了许多天然产物与特定靶点专一性结合的能力。作为新药发现和发展的重要途径之一,这些化学结构常常用于指导化学合成,使合成的化合物具有模拟天然产物的药效单元,其生物学效应也因此更具有针对性。
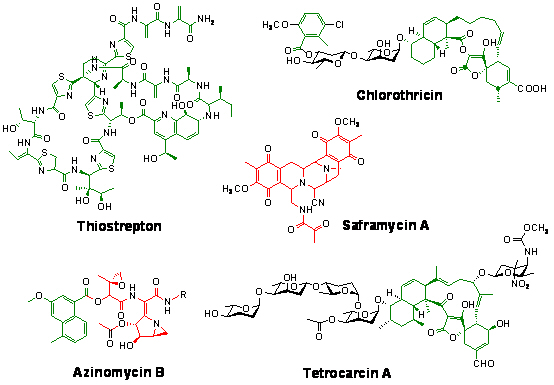
基于采用传统筛选和化学合成方法在发现和发展天然产物药物方面所存在的问题,组合生物合成(Combinatorial Biosynthesis)的出现为有机合成提供了有力补充,即利用微生物作为“细胞工厂”,通过对天然产物代谢途径的遗传控制来生物合成新型复杂化合物,并采用微生物发酵的方式达到大量生产的目的,同时降低生产成本和减少环境污染。目前,组合生物合成无论是在学术研究还是工业领域,对于新药开发的重大影响力正逐渐为科学家们所认同。它的成功运用,关键是在基因和蛋白功能水平上认识和阐明复杂天然产物的生物合成(Biosynthesis)机制,这是在微生物体内针对代谢途径进行遗传操作的分子和生化基础。在2004-2008年度期间,我们选取以活性显著、化学结构独特的复杂天然产物为目标(包括以螺环乙酰乙酸内酯类抗生素Chlorothricin和Tetrocarcin A为代表的聚酮类天然产物、以四氢异喹啉生物碱类抗生素Saframycin A为代表的聚肽类天然产物、抗肿瘤抗生素Azinomycin B为代表的聚酮/聚肽杂合类天然产物和以抗感染抗生素Thiostrpton为代表的硫肽类天然产物),从克隆生物合成基因簇出发,在生物合成途径的建立和新型酶学机制的阐明基础上,运用组合生物合成的策略获得结构类似物,以满足药物发现和发展过程中对于结构多样性的需求。同时,我们将基础研究中获得理论和方法应用于我国大宗抗生素产品工业用生产菌株的代谢工程改造,在发酵过程中提高有效组分的比例和产量。
尽管在这个研究周期较长的领域我们才刚刚起步,我们已经取得了可喜的成绩。四年内我们发表了研究论文7篇(包括Chem. & Biol. 2篇),撰写综述性文章2篇,专著章节2章,申请中国发明专利9项。在基础研究方面,关于聚酮/聚肽杂和类抗生素Azinomycin B生物合成途径的解析的工作,获得了Nature杂志系列关注中国科研发展的国际网站的Highlight(Nature China, 2008, doi:10.1038/nchina.2008.196);在应用研究方面,我们通过代谢途径的遗传修饰,得到了红霉素发酵过程中有效组分的比例得以优化和产量获得提高的新菌株,并已经在工业制造中完成放大和试生产。这个工作已经获得2008年上海市科技进步一等奖(与华东理工大学等单位合作)。
1.1 聚酮类(螺环乙酰乙酸内酯类)抗生素生物合成途径的建立:螺环乙酰乙酸内酯类抗生素是一类来源于不同微生物、具有多种生物活性的抗生素家族,其大环骨架的糖苷结构十分独特,拥有一个反式萘环系统和一个以螺环方式与己烯环相连的乙酰乙酸内酯结构单元。尽管其独特的化学结构和良好的生物活性引起了化学、生物和医药界的广泛关注,如何以之作为先导化合物发展更有价值的临床药物也成为各方努力的方向,但是,螺环乙酰乙酸内酯类抗生素复杂的化学结构为合成化学带来了巨大的挑战。在本研究中,我们克隆了完整的Chlorothricin和Tetrocarcin A的生物合成基因簇,建立了其次生代谢的基本途径,这是国际上首次有关这类抗生素家族生物合成途径在遗传水平的证实和报道(Jia et al. Chem. & Biol. 2006, 13, 575. 中国专利:200510027456.8)。
.jpg)
.jpg)
通过遗传水平的比较研究,我们鉴别了一组高度保守的独特基因负责特征性的乙酰乙酸内酯单元的形成(Fang et al. J. Bacteriol. 2008, 190, 6014. 中国专利:200810036248.8)。发现了一个新型聚酮合成酶(PKS)ChlB1以重复使用的方式负责6甲基水杨酸的合成。在细菌中,结构域组织为I型、PKS采用重复催化的机制合成芳香类化合物并不多见,在此之前仅有三个例子两种催化模式,我们发现的ChlB1是这一家族中的第三种模式(Shao et al. BBRC 2006, 345, 133)。基于建立的生物合成模型,我们通过代谢途径的遗传修饰,获得了一系列新型的结构类似物,其中一部分具有生物活性,充分证明了运用组合生物合成的原理和方法可以解决一些化学修饰难以解决的问题,以满足构效关系研究和新药开发领域对于结构多样性的需求。自研究工作发表以来,这部分研究被他人引用15次。在之后英国剑桥大学Peter F. Leadlay教授课题组和美国德克萨斯大学Hung-wen Liu教授课题组关于类似物Tetronomycin和Kijanimicin的生物合成研究中均着重比较了我们的研究结果。
1.2 聚肽类(四氢异喹啉生物碱类)抗生素生物合成机制的研究及新型重复使用非核糖体聚肽合成机制的发现:非核糖体聚肽合成酶(NRPS)催化的聚肽合成是聚肽类天然产物形成的主要机制之一。大部分聚肽合成酶包含多个功能结构域,采用一种线性机制负责聚肽链的延伸和在线修饰。基于这一看法,长期以来四氢异喹啉生物碱类抗生素的骨架形成机制也被认为严格遵循这一规律。在本研究中,我们通过该类化合物Saframycin A生物合成基因的克隆和生物合成途径的建立,发现了一种新型的非核糖体聚肽合成酶体系,采用一种不同于以往所发现的非线性机制催化四肽骨架的形成(Li et al. J. Bacteriol. 2008, 190, 251;Fu et al. J. Microbiol. Biotechol. 2009, doi: 10.4014/jmb.0808.484;中国专利:200710037087.X)。
通过序列分析的比较和底物特异性实验,我们初步证实了该家族的抗生素成员采用这一共同的合成策略来形成特征性的骨架结构。此外,我们以结构较为简单的Safracin B产生体系Psudomonas flurescens为基础,通过后修饰基因的补入和重组,构建了结构较为复杂的Saframycin(产生于链霉菌)代谢途径,从而为利用简单原核体系生产结构更为复杂、生物活性更好的类似化合物(如来源于海洋、结构与Saframycin相似的ET743)创造了条件。
.jpg)
.jpg)
1.3 Azinomycin B生物合成基因的克隆和新型重复使用I型聚酮合成酶的发现:Azinomycin B是一种具有良好抗肿瘤活性、功能基团高度密集的复杂天然产物,紧凑的结构中含有两个活性很强的反应中心:携带氮杂双环(1-azabicyclo[3. 1. 0]hex-2-ylidene)和环氧系统的两个氨基酸残基,其中类似的氮环结构仅在天然化合物Ficellomycin中发现。同位素标记实验表明,其萘甲酸结构单元可能来源于聚酮的生物合成途径,而三肽骨架部分则来源于三个高度修饰的氨基酸残基。推测Azinomycin B的生物合成代表了一类非典型的聚酮/聚肽杂合酶催化体系。在本项目中,我们克隆了染色体上长约80 kb、包含完整Azinomycin B生物合成基因簇的DNA区域,发现了包括编码新型聚酮合成酶、非核糖体依赖聚肽合成酶和一系列与独特氨基酸衍生单元形成相关的新基因(Zhao et al. Chem. & Biol. 2008, 15,693-705;中国专利:200810034378.8)。
.jpg)
为形成复杂而功能基团密集的化学结构,Azinomycin B的产生体系包含了多种生物合成的策略,例如:特殊结构单元的形成、聚酮合成后修饰、非核糖体聚肽合成酶的在线修饰以及还原性解离释放中间产物等。采用异源表达和定点突变的方法,我们发现了负责萘甲酸单元形成的重复使用聚酮合成酶AziB1,阐明了其新颖的选择性还原机制。同时,我们还重构了3-甲氧基-5-甲基-萘甲酸单元的合成路线。Azinomycin B生物合成基因的克隆和代谢途径的建立,不仅为深入研究氮杂双环和环氧系统等结构独特的药效基团的合成机制创造了条件,而且丰富了采用组合生物合成的手段扩展化合物结构多样性的新型基因储备。此项成果是和美国德克萨斯A&M大学Coran M.H. Watanabe教授课题组和英国埃克塞特大学Philip A.S. Lowden教授课题组同类研究的激烈竞争下取得的。关于Azinomycin B独特生物合成途径的解析,获得了Nature杂志系列关注中国科研发展的国际网站的亮点评述(Nature China, 2008, doi:10.1038/nchina.2008.196)。
A

B

C

1.4 硫肽类抗生素生物合成机制的解析:硫肽类抗生素是一类主要由放线菌产生的富含元素硫、并且氨基酸残基被高度修饰的环肽类抗生素。这一家族的绝大多数成员能够抑制细菌生长,其中部分抗生素对多种耐药性的条件致病菌具有极强的杀伤效果,如产生于放线菌Nocardia sp. WW-12651的Nocarthiacin,对Methicillin-resistant Staphylococcus aureus (MRSA)和Penicillin-resistant Streptococcus pneumoniae (PRSP)的抗菌活性分别达到0.007-0.03 g/ml和0.002 g/ml,比作为抗感染最后防线的万古霉素高出10-20倍;同时,Nocarthiacin对于近期出现的万古霉素抗性菌Enterococcus faecalis (VRE)也显示了良好的活性(0.03 g/ml)。研究表明,包括Thiostrepton、Micrococcin在内的硫肽类抗生素还具有明显的抗疟活性,在低浓度下可以抑制人类疟原虫Plasmodium falciparum的生长。
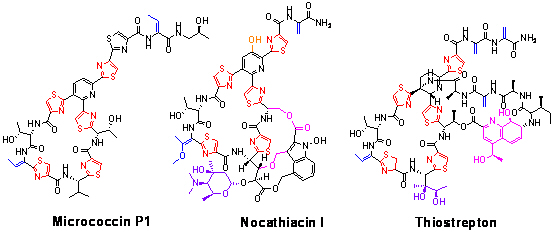
硫肽类抗生素的结构非常独特,所有成员都拥有一个3位或4位取代的嘧啶杂环、由脱水氨基酸和噻唑环或咪唑环所构成的环肽中心。尽管目前构效关系的研究还不十分清楚,但相似的化学结构决定了硫肽类抗生素抗菌活性的共同分子基础:通过结合细菌23SrRNA与核糖体蛋白L11所形成的复合体,抑制GTP-依赖的延伸因子的作用,从而最终抑制细菌的蛋白合成。
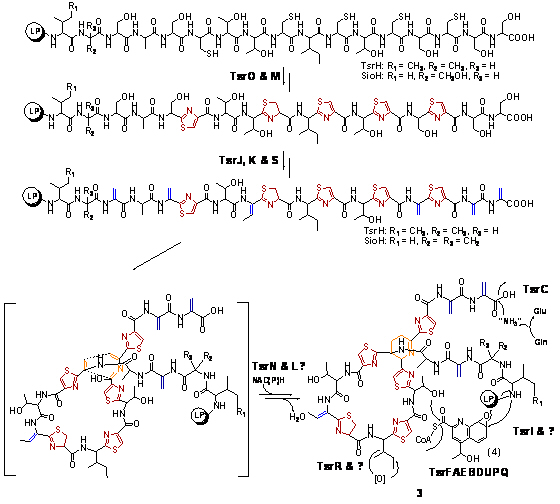
在本项目中,我们以Thiostrepton作为模型分子,在国际上首次发现了硫肽类抗生素的生物合成源于核糖体依赖的途径(Liao et al. Chem. & Biol. 2009, accepted; 中国专利:200810202416.6;中国专利:200810202417.0):前体肽在环化脱水酶/FAD-依赖脱氢酶的作用下首先形成聚噻唑或噻唑啉,接下来在脱水酶的催化下形成脱水氨基酸,同时构建了【4 + 2】环化反应中心,经分子内环合形成含氮6元环的中心。相对于繁杂的化学合成而言,硫肽类抗生素的生物合成路线相当简洁而高效。由于形成这些所有硫肽类抗生素所共有的特征性结构的机制相当保守,使得在遗传水平根据结构基因的同源性预测硫肽类抗生素的产生成为了可能。采用Genome Scanning的策略,我们推测枯草芽孢杆菌Bacillus cereaus ATCC14579具有产生其家族成员Thiocillin的能力,并通过大规模发酵、产物分离纯化和化合物结构鉴定等手段证实了这种可能性。这些研究为运用基因资源挖掘的方法发现硫肽类抗生素的新成员创造了条件。
1.5 6-甲基水杨酸(6-MSA)单元转移的酶学机制解析:6-MSA衍生结构单元对于螺环乙酰乙酸内酯类抗生素Clorothricin的稳定性十分重要。根据推测,在ChlB1的催化下形成的6-MSA最终要成为Clorothricin结构中的组成单元,需要首先从ChlB1转移至一个独立的酰基载体蛋白(ACP)上;经过甲基化和卤化修饰,再转移至侧链脱氧糖基的3位羟基上。序列分析结果表明,两个酰基转移酶ChlB3和ChlB6可能参与这一过程。
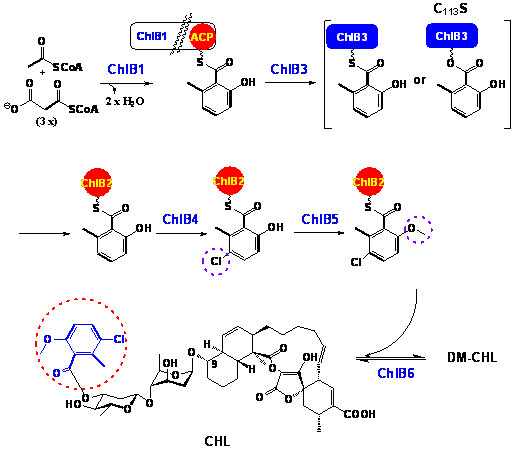
我们通过体内敲除和体外生化实验相结合的手段解析了6-MSA修饰和转移的酶学过程(He et al. ChemBioChem 2009, accepted)。编码基因chlB3和chlB6分别失活的两个突变菌株均产生了脱6-MSA的CHL结构类似物,证明了二者参与6-MSA转移的相关性。体外生化实验明确显示,ChlB3催化了6-MSA从I型聚酮合成酶ChlB1至ACP蛋白ChlB2的转移;而ChlB6则负责完成甲基化和卤化修饰的6-MSA衍生单元从ChlB2上转移至CHL侧链脱氧糖基的3位羟基上。后者的功能还可以通过逆反应进一步验证:CHL分子的6-MSA衍生单元可以在ChlB6的存在下脱去并重新转移至ChlB2上。此外,我们还通过位点特异性突变精确地鉴定了ChlB3中活性位点的关键氨基酸残基半胱氨酸:将其突变为丙氨酸后完全丧失了催化活性;而突变为丝氨酸则明显减缓了反应速度,并且HPLC和质谱分析都检测到了ChlB3偶联的6-MSA中间产物,证明6-MSA的转移需要ChlB3半胱氨酸残基的巯基(或丝氨酸残基的羟基)的介导。
1.6 红霉素发酵过程中有效组分的比例优化和产量提高:红霉素是一类在临床上广泛使用的、用于治疗革兰氏阳性菌感染的广谱大环内酯类抗生素。作为产量世界第一的原料药生产大国,目前我国的红霉素生产还存在着技术水平较低、生产成本较高的问题,主要表现在以下两个方面:一是菌株发酵产量低,与国外红霉素发酵单位相比,存在较大差距;二是有效组分比例偏低,发酵粗产物中红霉素有效组分A的含量只有70%,无效组分B + C的含量约为25%。为了达到出口标准(欧洲药典要求红霉素成品中有效组分A应高于95%,无效组分B + C的含量应低于3%)需经多步纯化,分离过程中其他红霉素相关组分没有被很好地利用,造成大量的环境污染和浪费,提高了产品成本,这是目前红霉素发酵工业中急需解决的问题之一。

在本研究中,我们以红霉素工业生产菌种为对象,探索通过在红霉素产生菌体内的遗传操作来提高红霉素的产量和改善有效成分红霉素A的比例,以解决传统诱变育种和化学合成难以解决的问题。我们构建了一系列重组菌株,系统性地调控红霉素有效组分A产生过程中两个后修饰酶(P450氧化还原酶EryK和氧甲基化酶EryG)的表达量和比例,可以发现无效组分B和C的含量均有不同程度的转化,有效组分A的含量均有一定程度的提高。其中的两株菌株中,无效组分B + C(25%)基本消失,而有效组分A的发酵效价提高了25-30%(Chen et al. Appl. Environ. Microbiol. 2008, 74, 1820-1828; 中国专利:200710173703.4;中国专利:200710173704.9. 图5)。相关研究内容已获得2008年度上海市科技进步一等奖(单位排名:华东理工大学、宜都东阳光生化制药有限公司、中科院上海有机化学研究所),已在湖北宜都东阳光生化制药有限公司进行放大和试生产。这些重组菌株在生产上得以成功运用,将明显简化下游纯化工艺、降低环境污染和改善产品质量,对提高我国红霉素产品的国际竞争力和促进发酵工业的发展发挥重要作用。

 沪ICP备05005485号
沪ICP备05005485号